Myélome: qu’est-ce que c’est ?
Le myélome est une maladie caractérisée par une cellule pathologique : le plasmocyte. Ce dernier représente un des stades cellulaires les plus avancés dans la maturation et la différenciation des globules blancs.
Ce sont des maladies du sang, malignes, caractérisées par la prolifération et la multiplication incontrôlée d’une catégorie de globule blanc, le plasmocyte, au sein de la moelle osseuse contenue dans les os. Au cours de cette maladie, les plasmocytes sont en quantité (excès) et de qualité (dystrophie) anormales. Cette maladie est désignée sous les noms de myélome multiple des os ou maladie de Kahler.
Dans la moelle osseuse où ont lieu la fabrication des globules et leur croissance, les globules blancs ont la capacité de donner naissance à deux grands types de cellules dont la vocation est de défendre l’organisme (contre les agents infectieux en particulier) :
- des cellules polynuclées, c’est-à-dire comportant plusieurs noyaux ;
- des cellules mononuclées comportant donc un seul noyau.
Les lymphocytes
Ils représentent en majorité les cellules mononuclées. Le plasmocyte est le stade ultime de différenciation du lymphocyte B, capable d’assumer les fonctions de défense de l’organisme. En effet, c’est le plasmocyte qui fabrique les anticorps (Ac) tout au long de la vie.
Les anticorps
Ces Ac sont des protéines qui circulent dans le sang ou s’accumulent au niveau de certains tissus de l’organisme. Ils correspondent à des immunoglobulines (Ig). Trois grands types d’Ig interviennent dans le système immunitaire de l’individu : les IgG, les IgA, et les IgM. Chaque Ig est composée par l’assemblage de chaînes lourdes et de chaînes légères complémentaires.
L’origine du plasmocyte malin
Il est vraisemblable que le plasmocyte malin retrouvé au cours du myélome naisse en réalité en dehors de la moelle osseuse, dans les autres organes hématopoïétiques (organes où se forment les cellules du sang) comme les ganglions et la rate. La cellule myélomateuse est porteuse d’une spécificité Ac, ce qui signifie qu’elle est capable de fabriquer des Ig portant toujours les mêmes caractéristiques G, A, ou M appelés déterminants idiotypiques.
Elle échappe aux mécanismes régulateurs normaux du processus de maturation d’affinité. La cellule plasmocytaire tumorale produit et excrète une Ig monoclonale dont la structure est le plus souvent normale, avec des chaînes lourdes et légères. Dans ces cas, l’Ig ne peut être filtrée par les reins du fait d’un poids moléculaire trop élevé. Elle s’accumule dans le sérum et apparaît sous la forme d’un pic lorsqu’on pratique une électrophorèse des protéines (examen qui permet d’analyser les protéines).
Quand les cellules myélomateuses produisent et excrètent uniquement des chaînes légères dans le sérum, il n’est pas observé de pic car ces chaînes légères, de bas poids moléculaire, sont filtrées par le rein et excrétées dans les urines. On observera alors dans ce cas une protéinurie (présence de protéines dans l’urine) avec un pic urinaire.
Pourquoi le plasmocyte devient-il malin ?
La (ou les) raison(s) de la progression vers la malignité d’un plasmocyte (qui est donc à l’origine une cellule normale et indispensable) et le développement d’un myélome restent encore inconnus. Un certain nombre d’anomalies de gènes ont pu être observées chez des patients porteurs de myélome sans que l’on retrouve de facteurs à l’origine de ces anomalies génétiques.
De surcroît, il existe plusieurs protéines produites à l’état normal par l’organisme qui peuvent stimuler et entretenir la multiplication des cellules plasmocytaires malignes. Parmi elles, l’interleukine-6 (IL-6) représente la protéine la plus impliquée, et des thérapeutiques bloquant la sécrétion de l’IL-6 ont pu être testées ces dernières années.
Myélome: comment le reconnaître ?
Reconnaître un myélome n’est pas toujours aisé. Son expression est très variable, allant de la forme indolente sans aucune manifestation à la forme agressive facilement reconnaissable. C’est pourquoi les examens complémentaires ont une place importante dans son diagnostic.
Un myélome multiple sera évoqué et devra être recherché devant les manifestations suivantes :
Une altération de l’état général
Il survient chez un homme entre 60 et 70 ans, et s’accompagnant de douleurs osseuses siégeant préférentiellement au niveau du rachis, ainsi qu’une accélération franche de la vitesse de sédimentation.
Une vitesse de sédimentation trop rapide
Une électrophorèse des protéines peut être demandée pour explorer une vitesse de sédimentation élevée et va révéler un pic anormal appelé pic monoclonal qui correspond à l’Ig synthétisée en excès par les plasmocytes.
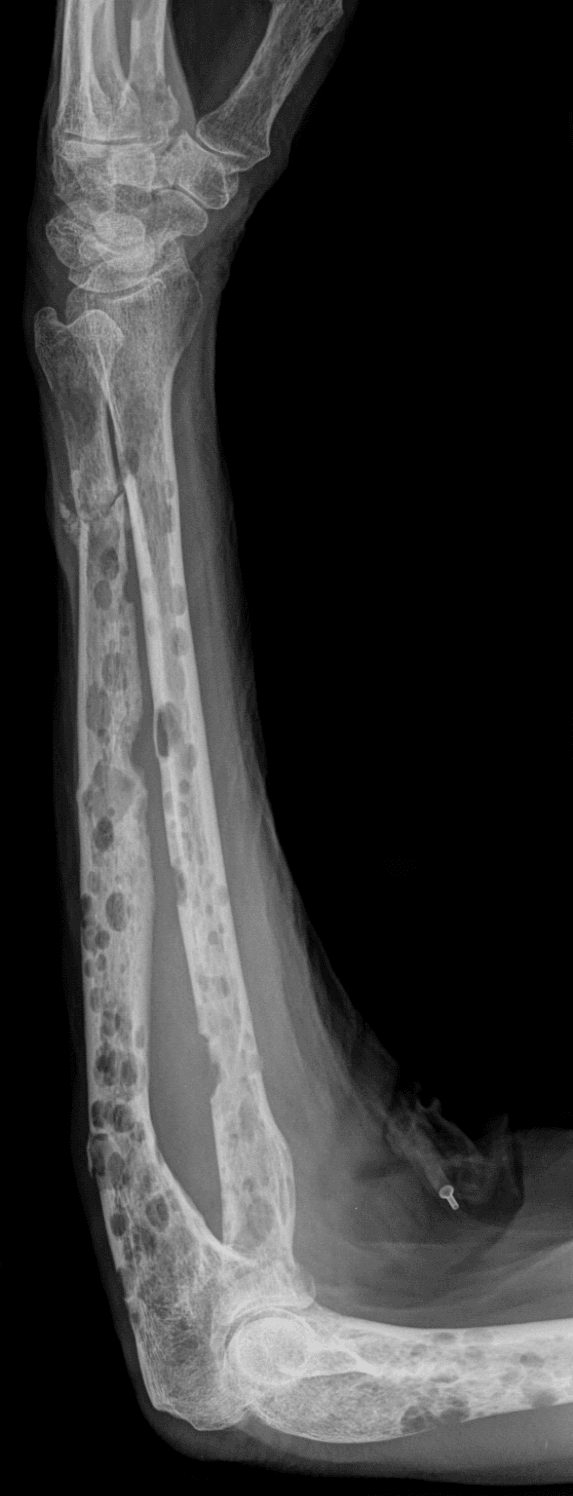
Une fracture pathologique
Une telle fracture peut annoncer la maladie. On attachera une attention particulière à des fractures avec tassements des vertèbres survenant en l’absence de tout facteur déclenchant de nature traumatique. Lorsque ces fractures-tassements se font au niveau lombaire, elles se manifestent sous la forme d’une souffrance des nerfs qui commandent les membres inférieurs et prennent l’allure d’une sciatique ou d’une cruralgie (relatif au nerf crural, dans la jambe).
Dans ces situations, le diagnostic est généralement aisé. Il existe par contre des signes cliniques et/ou biologiques plus ou moins évocateurs (anémie, insuffisance rénale, infections, hypercalcémie…), et une prise en charge rigoureuse et spécialisée s’impose pour rapidement étayer le diagnostic.
Le but de l’examen clinique d’un patient suspect de myélome
Il est dans la majorité des cas peu informatif avec l’absence d’hypertrophie des organes hématopoïétiques comme les ganglions ou la rate. On s’appliquera à rechercher des tumeurs osseuses siégeant préférentiellement au niveau du sternum, des côtes, du crâne, ou des clavicules. Néanmoins, ces tumeurs surviennent tardivement au cours de l’évolution et se rencontrent de moins en moins du fait de diagnostics plus précoces de nos jours.
L’électrophorèse et l’immunoélectrophorèse (IEP)
Ce sont deux examens de laboratoire fondamentaux pour établir le diagnostic de myélome multiple. L’électrophorèse va visualiser un pic étroit et pointu qui se situe le plus souvent dans la zone des gammaglobulines.
L’IEP va confirmer la présence de cette Ig monoclonale et déterminer sa nature : type de la chaîne lourde (gamma pour une IgG, alpha pour une IgA), et type de la chaîne légère (kappa ou lambda). Ainsi, par exemple, la conclusion du laboratoire pourra constater l’existence d’une immunoglobuline monoclonale de type IgGkappa.
Plus rarement, il n’est pas retrouvé de pic monoclonal à l’électrophorèse. Ces formes correspondent à des myélomes à chaînes légères exclusives et seule l’IEP pourra confirmer le diagnostic.
Le myélogramme
La ponction de la moelle osseuse (myélogramme) est indispensable au diagnostic. Elle met en évidence un excès de plasmocytes associé à des anomalies morphologiques (dystrophie).
Radiographie et résonance magnétique nucléaire
Des radiographies de l’ensemble du squelette (crâne, bassin, grill costal, os longs, rachis) sont systématiquement réalisées. Les anomalies osseuses les plus typiques de myélome apparaissent sous la forme de trous correspondant à une perte de substance osseuse (lyse osseuse), et définies sous le terme de géodes. Ces signes radiologiques ne sont pas toujours présents.
Des examens plus spécialisés comme la résonance magnétique nucléaire sont de plus en plus utilisés de nos jours car plus sensibles. De plus, la RMN peut visualiser des lésions de façon plus précoce que les radiographies standards.
Myélome: d’où cela vient-il ?
Aucun facteur ne peut être retenu aujourd’hui dans l’origine de la survenue d’un myélome.
On ne connaît à ce jour aucun facteur déclenchant ou prédisposant au développement d’un myélome. Il existe néanmoins une situation « bénigne » fréquente chez le sujet âgé au-delà de 60 ans et correspondant à la mise en évidence d’une immunoglobuline monoclonale de façon strictement isolée.
Ces situations sont définies sous le terme d’immunoglobuline monoclonale de signification indéterminée à condition qu’elles réunissent toutes les caractéristiques suivantes :
- Absence de toute manifestation clinique, en particulier pas d’altération de l’état général et pas de douleurs osseuses ;
- Absence de toute anomalie biologique, en particulier pas d’anémie, pas d’accélération de la vitesse de sédimentation, pas d’insuffisance rénale, calcémie normale ;
- Absence de lésions osseuses caractéristiques aux radiographies standards ;
- La protéine monoclonale doit être inférieure à 30 g/l ;
- Absence d’infiltration ou de dystrophie des plasmocytes au sein de la moelle ;
- Stabilité de ces différents critères dans le temps.
Mais la surveillance est fondamentale car une immunoglobuline monoclonale de signification indéterminée peut se compliquer d’un véritable myélome dans environ 10 % des cas. Cette évolution survient en moyenne après 10 ans d’évolution.
Myélome: comment cela marche-t-il ?
La prolifération plasmocytaire observée au cours du myélome va avoir des conséquences diverses dont l’expression reste variable.
Conséquences sur les cellules hématopoïétiques
Sur un plan purement quantitatif, la multiplication incontrôlée des plasmocytes au sein de la moelle osseuse va se traduire au bout d’un certain temps par une diminution des cellules médullaires souches et des précurseurs des différentes lignées sanguines.
Ceci se traduira ensuite par l’apparition d’une anémie, d’une leucopénie (diminution de la quantité de globules blancs), et/ou d’une thrombopénie (diminution de la quantité de plaquettes sanguines). Par ailleurs, le plasmocyte tumoral aura pour fonction principale la synthèse et l’excrétion de l’Ig monoclonale, et de ce fait il est fréquemment observé une diminution du taux sérique des Ig normales non myélomateuses. Il y aura par conséquent une diminution des anticorps (Ac) qui se traduira par un déficit de l’immunité, favorisant des infections principalement bactériennes.
Conséquences sur l’os
Les plasmocytes tumoraux sont capables de produire des substances solubles qui possèdent un effet destructeur sur l’os. Ceci se traduit cliniquement par des douleurs, voire des fractures osseuses, et apparaît à la radiologie sous la forme de géodes.
L’hypercalcémie (taux anormalement élevé de calcium dans le sang) parfois observée sur les bilans biologiques correspond au largage de substances minérales provoqué par la destruction osseuse.
Conséquences sur le rein
On observe une précipitation des chaînes légères au niveau du rein dans les tubules rénaux. En effet, du fait d’un excès considérable de ces chaînes légères, les capacités physiologiques de réabsorption du rein sont dépassées. ces chaînes légères sont donc éliminées dans les urines (l’anomalie biologique dans les analyses urinaires est désignée sous le terme de protéinurie de Bence-Jones).
L’Ig en totalité (chaînes lourde et légère) ne peut être filtré par les reins du fait d’un poids moléculaire trop élevé, elle ne se verra donc pas dans les urines. Ce mécanisme pathologique est à l’origine de l’insuffisance rénale observée au cours du myélome.
La mesure de la masse tumorale
Il existe une classification internationale qui permet d’apprécier la quantité de la masse tumorale. Cette classification, dite de Durie et Salmon, prend en compte des éléments biologiques (taux d’hémoglobine, calcémie, quantité de l’Ig sérique, quantité de la protéinurie) et radiologiques (existence et nombre de lésions osseuses).
Elle est également corrélée à la fonction rénale selon qu’elle soit conservée ou altérée. Trois stades peuvent être isolés en fonction du nombre de facteurs présents :
- le stade I correspond à une faible masse tumorale ;
- le stade II correspond à une masse tumorale intermédiaire ;
- le stade III correspond à une forte masse tumorale.
Cette classification est à la base de la décision thérapeutique. De nouveaux facteurs pronostiques sont également pris en compte de nos jours comme les taux sériques d’interleukine-6 et de bêta-2-microglobuline.
Myélome: Quels facteurs aggravants ?
Les facteurs aggravants sont toutes les complications pouvant se rencontrer au cours de l’évolution d’un myélome multiple des os et qui constituent autant de situations pouvant mettre en jeu le pronostic vital.
Les complications observées au cours d’un myélome sont souvent redoutables pouvant mettre en jeu le pronostic vital. Elles doivent être connues par le patient afin d’anticiper et de mettre en route un traitement adapté.
Les complications infectieuses
Elles sont très fréquentes en rapport avec le déficit immunitaire quasi-constant au cours du myélome. Elles sont le plus souvent d’origine bactérienne et se localisent préférentiellement aux niveaux broncho-pulmonaire et urinaire. Non traitées, elles peuvent se compliquer de septicémies mortelles (affections graves de l’organisme passant par le sang).
Par conséquent, toute fièvre doit faire rechercher une infection et un traitement par antibiotiques sera nécessairement mis en route dans les plus brefs délais. Des infections virales comme le zona sont également fréquentes et s’accompagnent souvent de douleurs très invalidantes.
Les complications osseuses
Les douleurs osseuses sont très fréquentes. Elles sont généralement très algiques (douloureuses) et répondent mal à des traitements antalgiques classiques. Le recours à des dérivés morphiniques est souvent nécessaire afin de soulager les patients.
Les fractures pathologiques représentent également une complication classique au cours d’un myélome :
- Elles sont sans conséquence grave quand elles concernent des os longs comme les humérus ou les fémurs.
- Lorsque la fracture concerne le rachis, elles peuvent être à l’origine d’une compression des racines nerveuses sous la forme d’une névralgie cervico-brachiale, d’une cruralgie, ou d’une sciatique.
- Quand la compression concerne la moelle (compression médullaire), cela devient une véritable urgence thérapeutique pour éviter la constitution d’une paralysie définitive.
L’hypercalcémie
Elle est fréquente et se diagnostique facilement par la mesure du taux sérique de calcium. Il faut par conséquent régulièrement surveiller la calcémie chez une personne porteuse de myélome. Par ailleurs, il faut savoir attacher une signification majeure à des signes cliniques parfois discrets et qui peuvent être symptomatiques d’une hypercalcémie (douleurs abdominales, diarrhée, troubles du comportement…). L’hypercalcémie met clairement en jeu le pronostic vital.
Complications rénales
L’insuffisance rénale est une complication potentielle dans l’évolution d’un myélome. Certaines situations peuvent la déclencher ou l’aggraver, comme un état de déshydratation, la prise de médicaments toxiques sur les reins (exemple des anti-inflammatoires non stéroïdiens), ou l’injection de produits de contraste iodée couramment utilisés lors d’examens radiologiques comme le scanner. Lorsqu’elle est définitivement constituée, l’insuffisance rénale nécessite des séances de dialyse rénale en continu.
Myélome: comment vivre avec ?
Le respect de principes fondamentaux et élémentaires s’impose pour réduire le risque de complications quasi obligatoires dans l’évolution d’un myélome.
Des conseils d’hygiène et de diététique doivent être clairement formulés aux patients porteurs de myélome afin d’éviter la survenue des complications.
Les complications infectieuses
Toute fièvre doit faire rechercher une infection et un traitement par antibiotiques sera rapidement mis en route. Les patients devront éviter un contact fréquent et rapproché avec des enfants en bas âge susceptibles d’incuber une maladie virale contagieuse.
De la même façon, il est prudent d’éviter les lieux publics massivement fréquentés. Une vaccination antigrippale est souvent recommandée au début de l’automne afin de réduire le risque épidémique.
Les complications osseuses
Une hygiène de vie sera fortement recommandée en évitant le port de charges lourdes et en prodiguant des conseils de posture et de mouvements. Des trajets longs en voiture sont à éviter ainsi que des manipulations osseuses ou vertébrales.
Les complications rénales et l’hypercalcémie
Une hydratation abondante est conseillée de même qu’on restreindra une alimentation trop riche en calcium. Toute prise médicamenteuse devra être soumise à l’appréciation du médecin.
Myélome: quel traitement ?
A part quelques rares cas de myélomes indolents qui n’évoluent pas pendant plusieurs années, le myélome multiple des os reste une maladie maligne grave dont l’évolution spontanée sans traitement est toujours mortelle en quelque mois (la survie médiane est de l’ordre de 8 mois). Le traitement est donc indispensable.
Si l’abstention thérapeutique avec une surveillance clinique et biologique rigoureuse reste toujours recommandée dans les myélomes à faible masse tumorale (stade I), le traitement est toujours indiqué chez des patients porteurs de myélomes évolutifs (stades II et III). (voir la classification de ces différents stades au chapitre « Comment cela marche-t-il ? »)
La prise en charge thérapeutique fait appel à deux grands principes, l’éradication de la prolifération plasmocytaire maligne et le traitement symptomatique des complications potentielles.
Comment éradiquer la prolifération plasmocytaire maligne ?
Seuls les traitements à visée cytotoxique (éliminer les substances toxiques pour certaines cellules) comme la chimiothérapie et la radiothérapie laissent entrevoir la possibilité d’éradiquer les cellules plasmocytaires tumorales. Malheureusement cette éradication n’est jamais définitive et les rechutes sont constantes. C’est la raison pour laquelle on parle plus volontiers de rémission que de guérison. Les traitements deviennent de moins en moins efficaces après ces rechutes, et les périodes de rémission deviennent de plus en plus courtes.
L’intensité de la chimiothérapie dépend avant tout de l’âge du patient et de son terrain. La drogue de chimiothérapie principalement active dans les myélomes est représentée un agent « alkylant » (ou « alcoylant », l’alcoyle étant obtenu par la soustraction d’un atome d’hydrogène à un alcane) en association à de fortes doses de corticothérapie.
Ces deux médicaments définissent le traitement thérapeutique le plus utilisé au monde. Au bout de 3 à 6 mois d’un tel traitement et chez les patients âgés de moins de 65 ans, il est licite de proposer une intensification de la chimiothérapie. Cette intensification repose sur l’utilisation de très fortes doses de chimiothérapie associée ou non à une irradiation corporelle totale.
Pour réduire la toxicité notamment hématologique de cette thérapeutique intensive, on a recours à des facteurs de croissance hématopoïétiques ainsi qu’à des cellules souches périphériques autologues préalablement prélevées au patient.
L’autogreffe (les cellules sont prélevées sur la même personne) de cellules souches périphériques représente de nos jours le traitement standard recommandé chez des patients âgés de moins de 65 ans et porteurs de myélomes multiples. Cette stratégie permet d’obtenir les rémissions les plus longues lorsque le patient y est répondeur. Chez les patients âgés de plus de 65 ans, il est recommandé de poursuivre le classique pendant une durée au moins égale à 12 mois.
L’allogreffe (les cellules sont prélevées sur une tierce personne) de moelle osseuse a des indications limitées car elle se heurte à au moins deux difficultés : la nécessité d’avoir un donneur familial compatible, et les risques morbides et mortels importants. De plus, la réalisation de l’allogreffe se trouve souvent confrontée à un âge élevé des patients. Il s’agit néanmoins d’une stratégie thérapeutique qui, à l’inverse de tous les autres traitements, pourrait laisser entrevoir de véritables guérisons.
Des traitements immuno-modulateurs comme l’Interféron, afin de renforcer l’immunité antitumorale de l’individu, ont pu être testés sans qu’on puisse conclure de façon claire sur leur efficacité.
Plus récemment, des traitements qui inhibent la vascularisation des tumeurs et donc leur survie ont été proposés chez des patients porteurs de myélomes multiples réfractaires ou en rechute. On dispose à ce jour de trop peu de recul pour juger de leur intérêt.
Quel peut être le traitement des complications ?
Tous ces traitements passent par une prise en charge spécialisée. La meilleure attitude passe par la prévention de ces complications, ce qui revient à dire qu’il est impératif de traiter la maladie avant la survenue des complications.